SÍNDROME DA INSUFICIÊNCIA ANDROGÊNICA (SIA)
- No resumo anterior, discorri sobre a síntese de hormônios androgênios na mulher e suas ações fisiológicas nos mais diversos tecidos e órgãos.
- Agora, veremos as consequências da redução da produção dos hormônios androgênios no organismo feminino.
- Apesar da produção de androgênios naturalmente declinar progressivamente ao longo do período reprodutivo da mulher, essa redução fisiológica pode gerar um conjunto de sintomas clínicos relacionados ao estado de deficiência androgênica que se manifesta com diminuição da função e desejo sexual, aumento da fadiga, instabilidade vasomotora, piora na composição corporal, perda de massa óssea além de outros sinais e sintomas que comprometem o bem estar da mulher.
- Esse conjunto de sintomas pode ser sobreposto, em parte, pela redução da produção de estrogênios no período da perimenopausa, pois lembre-se que há uma correlação direta entre a síntese de androgênios e a síntese de estrogênios, já que os androgênios são percursores dos estrogênios (esse assunto é explicado melhor no artigo anterior).
A REDUÇÃO DA PRODUÇÃO DE TESTOSTERONA E SEUS DERIVADOS NAS MULHERES
- As concentrações séricas de andrógenos (testosterona e androstenediona) e de seus percursores (S-DHEA e DHEA) diminuem gradualmente em mulheres em idade reprodutiva, com atenuação da redução após a menopausa,
- A redução é mais acentuada a partir da terceira década de vida, de modo que aos 60 anos de idade, as concentrações séricas de S-DHEA e DHEA são de aproximadamente 30 % daquelas encontradas aos 30 anos de idade, como podemos observar no gráfico abaixo a direita.
- No gráfico abaixo a esquerda, observa-se a redução dos níveis urinários de 17-cetoesteróides que são substâncias formadas a partir do metabolismo dos andrógenos e eliminados na urina.

Dados de: Zumoff B, Rosenfield RS, Strain GW, et al. J Clin Endocrinol Metab 1980; 51:330.
- Apesar dessa significativa redução dos níveis de androgênios, a maior redução na produção hormonal ocorre na produção de estrogênios.
- A produção de testosterona ovariana permanece relativamente constante após a menopausa, ao contrário da produção de estrogênios que decai mais significativamente. Isso se deve ao aumento da secreção de gonadotrofina, que estimula a esteroidogênese em células do estroma nos ovários.
- Dessa forma, no processo da menopausa, geralmente observamos que as reduções absolutas nos estrogênios são mais significativas do que a redução de androgênios, gerando um quadro de hiperandrogenismo relativo (balanço T : E2).
- Portanto, muitos dos sintomas de diminuição da sensação de bem-estar, humor disfórico, fadiga persistente, redução da libido, da receptividade sexual e do prazer, sintomas vasomotores e diminuição da lubrificação vaginal, podem ser causados pelo sinergismo da redução dos hormônios androgênicos com a redução dos hormônios estrogênicos.
CAUSAS
- As possíveis causas de sintomas relacionados a baixa produção de androgênios nas mulheres são:
- Insuficiência ovariana
- Insuficiência adrenal
- Ooforectomia bilateral
- Remoção cirúrgica dos ovários.
- Hipopituitarismo
- O acometimento da hipófise causa uma deficiência da produção dos hormônios hipofisários, como a corticotropina (ACTH) e as gonadotropinas (LH e FSH), reduzindo a produção de androgênios pelas adrenais e pelos ovários.
- Terapia estrogênica
- O uso de estrogênios orais, mesmo em doses baixas (terapia da menopausa), reduz as concentrações séricas de testosterona biodisponível através do aumentando os níveis séricos da SHBG.
- Uso de anticoncepcionais
- Muitas progestinas apresentam ação antiandrogênica.
- Elas podem se ligar a receptores de androgênio (AR) atuando de forma antagonista competitivo.
- Além disso, podem inibir a ação da enzima 5-alfa-redutase que transforma a testosterona em DHT que é um androgênio muito mais potente.
- Os anticoncepcionais, através do mecanismo de feedback negativo, reduzem a secreção dos hormônios hipofisários (FSH e LH) que consequentemente, reduzem a produção dos hormônios sexuais gonadais como a testosterona e o estrogênio.
- Uso de corticosteroides
- As glândulas suprarrenais são uma fonte importante de androgênio nas mulheres.
- O ACTH estimula a produção tanto do cortisol quanto dos androgênios adrenais, porém apenas o cortisol tem ação hipotalâmica e hipofisária com feedback negativo no ACTH e CRH.
- O eixo hipotalâmico-hipofisário-adrenal (HHA) é suprimido com doses superiores de 20 mg por dia de prednisona ou seu equivalente por mais de 3 semanas.
- Corticosteroides tópicos, particularmente os agentes de alta potência, podem causar supressão significativa do eixo HHA com o uso de apenas 2 gramas por dia por mais de 2 semanas.
- Síndrome da Deficiência Energética Relativa no Esporte (RED-S)
- Acomete principalmente atletas de alta performance experientes e é caracterizada pela falta de energia adequada para a prática esportiva.
- O permanente estado deficitário de energia, leva a uma redução da pulsatilidade do hormônio hipotalâmico GnRH e com redução da secreção de hormônios hipofisários (LH e FSH) levando a uma baixa produção de vários hormônios esteroidais, entre eles os androgênios.
- Anorexia
QUADRO CLÍNICO
- Os principais sinais e sintomas causados pela insuficiência de androgênios são:
- Diminuição da densidade mineral óssea ocasionando um aumento do risco de fraturas
- Perda de massa muscular e ganho de gordura corporal
- Diminuição da sensação de bem estar geral e da disposição
- Alterações no humor
- Desejo sexual hipoativo
- Instabilidade vasomotora
- Redução da lubrificação vaginal
EXAMES LABORATORIAIS
- O diagnóstico da Síndrome da Insuficiência Androgênica (SIA) é essencialmente clínico, não havendo evidências atuais da necessidade de realização de exames laboratoriais para sua comprovação.
- Além disso, os ensaios clínicos usados para a dosagem das concentrações dos andrógenos séricos não são padronizados, implicado em muitos erros de leitura e de avaliação.
- Quando solicitados, os exames mais recorrentes são:
- S-DHEA
- Testosterona total e livre
- SHBG
- Androstenediona
- 17-OH-Progesterona
DOSAGEM DA TESTOSTERONA NA MULHER
- Os testes laboratoriais para dosagem de testosterona total e livre na mulher são de baixa sensibilidade e de pouca precisão.
- Os métodos de quantificação disponíveis mais utilizados são: a quimioluminescência e o enzimaimunoensaio. O coeficiente de variação desses métodos (erro) é significativo, sendo a variação tanto maior quanto menor for a concentração de testosterona na amostra, especialmente para valores inferiores a 200 ng/dL.
- Além disso, nas mulheres, ocorre grande variação fisiológica na secreção de testosterona referentes a idade, fase do ciclo menstrual, hora do dia, rotina de treinamento, uso de contraceptivos hormonais.
- Idealmente, se for necessária a dosagem, ela deve ser feita na fase folicular no período da manhã.
- A referência de testosterona total para mulheres está entre 15 a 70 ng/dL.
- A dosagem da testosterona geralmente é indicada para acompanhamento da terapia androgênica a fim de evitar elevações suprafisiológicas e não para constatação de baixos níveis de testosterona.
DISFUNÇÃO SEXUAL
- As queixas sexuais são altamente prevalentes entre as mulheres.
- A disfunção sexual feminina assume diferentes formas, incluindo a falta de desejo sexual, diminuição da excitação, incapacidade de atingir o orgasmo, dor durante a atividade sexual ou uma combinação desses problemas.
- Nas mulheres, o ciclo de resposta sexual é composto por uma sequência de eventos, iniciando com o desejo (libido), consolidando com a excitação, atingindo o auge com o orgasmo e terminando com a resolução. Todavia, essa sequência nem sempre ocorre, podendo naturalmente haver sobreposição, repetição ou ausência de alguma fase.
- Além disso, a satisfação sexual é algo muito subjetivo. A disfunção sexual feminina é multifatorial, muitas vezes com várias etiologias diferentes contribuindo para o problema. Muitos fatores podem estar sobrepostos como:
- Fatores endócrinos
- Fatores neurológicos
- Fatores anatômicos genitais
- Fatores vasculares
- Fatores psicológicos e culturais
MODULADORES HORMONAIS E NEUROTRNAMISSORES
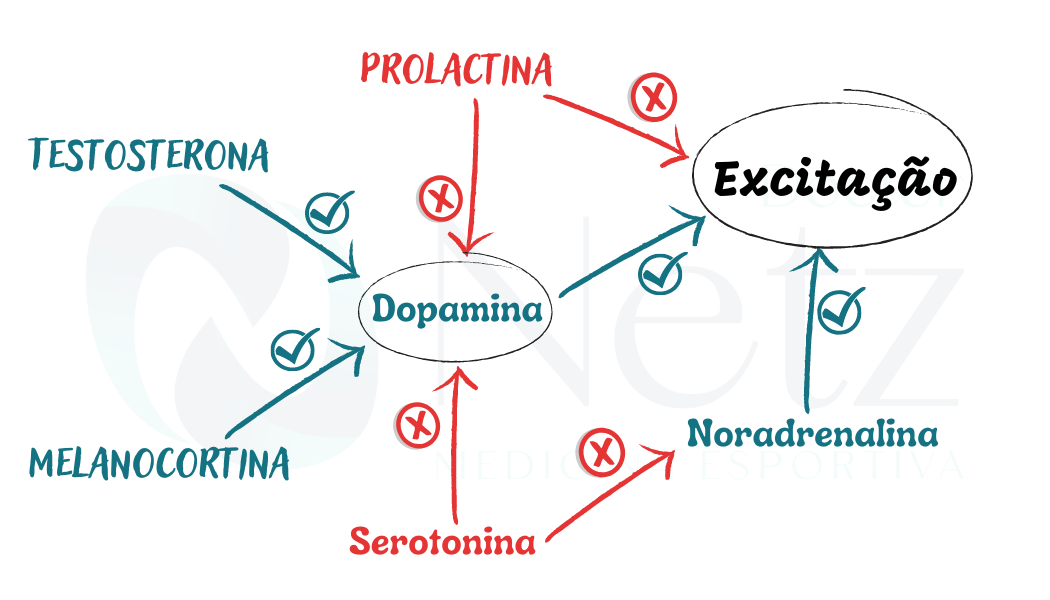
- A função sexual feminina apropriada requer equilíbrio dos neurotransmissores: dopamina, adrenalina, noradrenalina e serotonina para gerar desejo, excitação e orgasmo.
- Distúrbios e medicamentos que perturbam os níveis desses neurotransmissores podem levar à disfunção sexual.
- O estrogênio é outro hormônio chave para uma resposta sexual feminina adequada. Ele mantém o epitélio vaginal espesso, estimula a lubrificação vaginal, modula o fluxo sanguíneo vaginal através da regulação da VIP e NOS em conjunto com os androgênios.
- Já os hormônios androgênios, prolactina, ocitocina estão envolvidos no processo de ativação ou inibição das vias neurais que causam a excitação sexual feminina.
- Em relação aos neurotransmissores, a via dopaminérgica mesolímbica-cortical é a via relacionada ao desejo, gratificação, recompensa, prazer e reforço.
- Essa via se inicia na área tegmental ventral do mesencéfalo e forma conexão com o sistema límbico através do núcleo accumbens, da amígdala cerebelosa e do hipocampo, terminando no córtex pré-frontal medial.
- Além disso, essa via de neurotrasmissão está envolvida na modulação das respostas comportamentais aos estímulos que ativam as sensações de recompensa através do neurotransmissor dopamina.
- Tanto a dopamina quanto a norepinefrina desempenham um papel crítico na excitação sexual, com a norepinefrina desempenhando um papel estimulante na excitação sexual e a dopamina desempenhando um papel no aumento do desejo.
- A via dopaminérgica mesolímbica-cortical é estimulada ou inibida por vários hormônios e neurotransmissores, como por exemplo:
- Testosterona
- A testosterona é outros androgênios estimulam a via dopaminérgica.
- Prolactina
- A prolactina inibe a via dopaminérgica.
- Na amamentação, o nível elevado da prolactina é um dos responsáveis por gerar o sintoma de depressão no pós-parto.
- Serotonina
- A serotonina causa inibição da noradrenalina e da dopamina.
- Os antidepressivos da classe Inibidores Seletivos da Recaptação da Serotonina (ISRS), aumentam a disponibilidade da serotonina na fenda sináptica e tem como efeito adverso frequente a perda da libido.
- Testosterona
DESORDEM DE INTERESSE OU EXCITAÇÃO SEXUAL
- Dentre as queixas sexuais, a redução do desejo e dificuldade de atingir o orgasmo são as mais prevalentes entre as mulheres.
- A redução da libido afeta mulheres de todas as idades, com um pico de prevalência e de intensidade associado na meia-idade.
- A falta de interesse e de excitação sexual pode envolver mais de uma fase de resposta sexual (desejo, excitação, orgasmo), ou ainda estar associada a dor sexual ou uma diminuição geral da satisfação sexual.
- A disfunção sexual é definida como um problema sexual que é persistente ou recorrente por mais de 6 meses e causa angústia pessoal acentuada ou dificuldade interpessoal.
- A intervenção é justificada quando uma mulher apresenta uma preocupação sexual importante, mesmo que não cumpra estritamente os critérios acima do Manual Diagnóstico e Estatístico de Transtornos Mentais, Quinta Edição, DSM-5.
- Existem muitos tratamentos possíveis para a falta de interesse ou excitação sexual, devendo ser discutido os benefícios e malefícios de cada método, buscando encontrar o método mais adequado para cada paciente.
- Basicamente, os pilares do tratamento consistem em terapia, mudança de estilo de vida, revisão do uso de medicações, terapia androgênica e terapia não androgênica.
TRATAMENTO NÃO ANDROGÊNICO PARA DISFUNÇÃO SEXUAL
1. FLIBANSERINA
- A Flibanserina é um agente serotoninérgico multimodal e agente dopaminérgico.
- É a primeira droga aprovada pelo FDA para disfunção sexual feminina em mulheres na pré-menopausa.
- Trata-se de um agonista e antagonista altamente seletivo de receptores de serotonina de ação central (a depender do tipo de receptor e da região cerebral) que resulta em diminuições transitórias da serotonina e aumentos na dopamina e norepinefrina em certas regiões do cérebro.
- Inicialmente, foi estudado como um antidepressivo potencial e, embora fosse pouco eficaz para a depressão, causava o efeito incomum, entre as classes de medicações antidepressivas, de aumentar o desejo sexual.
- Os estudos mostram que a Flibanserina resulta em pequenos aumentos no desejo sexual e na frequência de eventos sexuais em mulheres com baixo desejo sexual.
- Uma meta-análise que incluiu oito ensaios clínicos duplo-cegos e randomizados com um total de 5914 mulheres, a Flibanserina, em comparação com o placebo, resultou em um aumento pequeno, mas estatisticamente significativo, em eventos sexuais por mês em mulheres na pré-menopausa e na pós-menopausa com transtorno do desejo sexual hipoativo.
- O FDA aprovou em 2015 a Flibanserina para tratamento de mulheres na pré-menopausa com baixo desejo sexual e com sofrimento associado, a uma dose diária de 100 mg na hora de dormir com várias notas de advertência.
- A Flibanserina não é indicada para o tratamento da disfunção sexual em mulheres pós-menopáusicas.
- Os efeitos adversos mais comuns documentados são: sonolência, tontura, hipotensão, síncope.
- Não há previsão de aprovação dessa medicação pela ANVISA no Brasil.
2. BREMELANOTIDE
- O Bremelanotide é um agonista do receptor de melanocortina e foi aprovado pelo FDA em junho de 2019 para o tratamento de transtorno do desejo sexual hipoativo em mulheres na pré-menopausa.
- O medicamento é administrado por injeção subcutânea (1,75 mg) pelo menos 45 minutos antes da atividade sexual prevista.
- Dois estudos randomizados em um total de 1.247 mulheres na pré-menopausa com transtorno do desejo sexual hipoativo mostraram que o uso de Bremelanotida por 24 semanas, em comparação com placebo resultou em um aumento significativo no desejo sexual e melhora na satisfação sexual.
- As reações adversas mais comuns são: náuseas, principalmente com a primeira injeção, vômitos, rubor, dor de cabeça e hiperpigmentação.
- Uma vantagem da Bremelanotida em comparação com a Flibanserina é que ela é tomada sob demanda, antes da atividade sexual prevista, reduzindo potencialmente os riscos e efeitos colaterais.
- Semelhante a outras medicações, o uso deve ser recomendado a mulheres que experimentam sofrimento devido à baixa libido, sem outra etiologia para o problema sexual, após a ineficácia de outras intervenções não farmacológicas.
TERAPIA HORMONAL ANDROGÊNICA
- O uso de diversos andrógenos foi estudado como possível alternativa para o tratamento de sintomas relacionadas ao baixo nível de androgênios, como por exemplo a disfunção sexual.
- Muitas dessas terapias não foram aprovadas pela agência reguladora americana (FDA) tão pouco pela brasileira (ANVISA), sendo o seu uso considerado off-label.
- Vale ressaltar que as terapias com androgênios ainda carecem de estudos robustos atestando a sua segurança de uso no longo prazo.
- A seguir, veremos com mais detalhes as particularidades das terapias com androgênios já estudadas.
1. TESTOSTERONA TRANSDÉRMICA
- A testosterona é o principal hormônio androgênico utilizado no tratamento de sintomas relacionados a desordem do interesse ou excitação sexual ou disfunção sexual.
- É um dos hormônios esteroidais com maior potencial androgênico, ou se seja, apresenta alta afinidade com receptores androgênicos (AR) estimulando o desenvolvimento das características secundárias masculinas.
- A testosterona apresenta um importante efeito na melhora da função sexual feminina, porém apresenta também um alto potencial em causar efeitos virilizantes. Por isso, seu uso deve ser controlado e acompanhado com profissional habilitado.
- A terapia com testosterona exógena demonstrou melhorar vários aspectos da função sexual feminina em populações selecionadas de mulheres na pós-menopausa que apresentavam o distúrbio de interesse ou de excitação sexual feminino.
- Os benefícios foram relatados para alguns aspectos da sexualidade, incluindo desejo, capacidade de resposta, orgasmo e satisfação.
- Além disso, a adição de testosterona à terapia de estrogênio pós-menopausa (com ou sem progesterona) em mulheres que se submetem à menopausa naturalmente ou como resultado de ooforectomia (menopausa cirúrgica) demonstrou melhorar a função sexual em revisões sistemáticas de ensaios randomizados.
- O uso de testosterona na menopausa em doses dentro do nível fisiológico encontrado em mulheres pré-menopausa, pode aumentar o risco de acne e hirsutismo, porém não costuma causar alteração de voz ou hipertrofia do clitóris, ou seja, não costuma causar virilização.
- Além disso, alguns estudos mostraram que a testosterona, nas doses geralmente usadas para tratar o transtorno do desejo sexual hipoativo, não parece ter efeito benéfico significativo na densidade óssea, composição corporal, humor, cognição ou sintomas vasomotores.
- A via de administração transdérmica e as vias parenterais são as vias preferenciais de administração, pois evitam a as consequências do metabolismo de primeira passagem das formulações orais.
- A testosterona apresenta uma moderada permeabilidade cutânea, que depende da lipofilicidade e hidrofilicidade do composto. Quanto mais lipofílico a substância, maior a permeabilidade na pele.
- O transporte da testosterona pela pele, inclui a difusão pelo estrato córneo, epiderme e derme, por um processo de difusão passiva seguida da absorção pelos capilares locais.
- O local de aplicação da testosterona transdérmica pode influenciar a sua biodisponibilidade.
- Uma desvantagem da via transdérmica é a grande variabilidade interindividual e intraindividual nos parâmetros farmacocinéticos.
- A absorção pode aumentar no verão, devido as altas temperaturas que causam dilatação dos poros na pele e aumentam a vascularização.
- As formas de apresentação de testosterona transdérmica mais comuns são o gel e o adesivo.
- A administração de testosterona por adesivos transdérmico, nas doses diárias de 150 mcg a 300 mcg, demonstram ter bons resultados sobre a sexualidade feminina com um bom perfil de segurança durante o período de 6 meses de uso.
- A dosagem do nível de testosterona não deve ser usada para determinar a etiologia de um problema sexual ou para avaliar a eficácia do tratamento, pois vários estudos grandes e bem planejados confirmam a ausência de uma correlação significativa entre os níveis de androgênio e a função sexual.
- A dosagem sérica costuma ser reservada para o monitoramento da terapia androgênica evitando níveis suprafisiológicos de testosterona e seus efeitos virilizantes.
2. TESTOSTERONA ORAL
- A administração de andrógenos por via oral leva ao metabolismo de primeira passagem hepática que pode repercutir em efeitos colaterais no perfil lipídico e lipoproteico, com redução dos níveis do colesterol HDL e aumento do colesterol LDL.
- A testosterona por via oral com apresentação alquilada (metiltestosterona) tem absorção intestinal e resiste a metabolização e inativação hepática.
- Doses de 1,25 a 2,5 mg/dia são as preconizadas com maior experiência clínica.
- A forma micronizada oral não é bem absorvida e resulta em níveis plasmáticos insuficientes para manifestar efeito terapêutico.
- O undecanoato de testosterona oral, com efeito hepático menor do que a metiltestosterona, foi empiricamente usado na dose de 40 mg/dia em mulheres no tratamento de sintomas relacionados aos baixos níveis de androgênios.
3. ANDROSTENEDIONA
- Os efeitos do uso de androstenediona são controversos.
- Alguns estudos mostraram que a administração de androstenediona em mulheres aumenta as concentrações séricas de testosterona e de estrona.
- Porém, outros ensaios randomizados controlados com placebo de androstenediona, não comprovam o aumento das concentrações de testosterona nem melhora de sintomas relacionadas a redução dos níveis de androgênios.
4. DHEA
- O DHEA não é considerado um androgênico em si, e sim um percursor de esteroides, tanto da testosterona quanto do estrogênio.
- Existem algumas evidências mostrando melhora do humor e na qualidade de vida em mulheres com insuficiência adrenal e no período pós-menopausa.
- Alguns estudos randomizados, duplo-cego e placebo controlados, realizados em grupos de mulheres com insuficiência adrenal ou no período pós-menopausa, mostraram que mulheres que fizeram uso de DHEA em doses que variaram entre 25 e 100 mg/dia, durante um período de tempo de 3 a 12 meses, melhoraram de forma significativa o bem-estar, o humor e a fadiga, com diminuição da ansiedade e da depressão em relação as mulheres que usaram placebo.
- Porém, os dados de ensaios clínicos sobre a eficácia da terapia com DHEA em mulheres, em sua maioria são mistos.
5. TIBOLONA
- Trata-se de um esteroide sintético, cujos metabólitos apresentam propriedades estrogênicas, progestogênicas e, principalmente, androgênicas.
- A tibolona reduz os sintomas vasomotores quando comparada ao placebo, mas parece ser menos eficaz que a terapia com estrogênio.
- Apresenta um efeito benéfico na densidade mineral óssea (DMO) e pode ter um efeito modesto nos sintomas de disfunção sexual, promovendo aumento da libido.
- Comprimidos contendo 1,25 ou 2,5 mg, de uso diário, são usualmente usados para alivio da síndrome climatérica.
- Porém, o uso da tibolona parece aumentar o risco de recorrência de CA de mama em mulheres com histórico pessoal, ou seja, que já tiveram o diagnóstico antes. Além disso, ela supostamente pode aumentar o risco de AVE em mulheres com mais de 60 anos.
6. OXANDROLONA
- Trata-se de um hormônio esteroidal androgênico, derivado da diidrotestosterona (DHT), e menor efeito androgênico em relação a testosterona, cerca de um quarto (1/4) do efeito da testosterona, porém com maior potencial anabólico, cerca de 3-6 vezes o potencial da testosterona.
- Esse menor potencial androgênico em relação a testosterona, torna a oxandrolona menos provável de causar efeitos virilizantes, quando usada em doses terapêuticas.
- Quando administrada por via oral, leva ao metabolismo de primeira passagem hepática que pode repercutir em efeitos colaterais semelhantes ao da metiltestosterona, porém, aparentemente, de menor magnitude.
- Por ser derivada da DHT, não sofre ação da enzima Aromatase, ou seja, não aumenta os níveis séricos de estrogênio.
- Além da ação direta em receptores androgênicos (AR), a oxandrolona apresenta a propriedade de reduzir os níveis séricos da proteína carregadora dos hormônios sexuais (SHBG) tornando a testosterona circulante mais biodisponível aos tecidos.
MONITORAMENTO DA TERAPIA ANDROGÊNICA
- O principal objetivo da terapia androgênica é tratar os sintomas relacionados a falta de androgênios que causam real sofrimento ao paciente, obtendo concentrações plasmáticas normais ou próximas ao limite superior da normalidade.
- Exames laboratoriais de acompanhamento devem ser feitos antes e após 60 dias do inicio da terapia androgênica, com avaliação do hemograma, perfil lipídico, dano e função hepática e perfil hormonal.
- Mulheres em terapia androgênica devem ser monitoradas quanto a potenciais efeitos adversos, como por exemplo os efeitos cosméticos (hirsutismo, oleosidade da pele, acne, queda de cabelos) e efeitos virilizantes (engrossamento da voz, aumento do clitóris, alterações na fisionomia do rosto).
- A testosterona pode ser metabolizada em estrogênio e, portanto, sangramento uterino anormal ou sintomas mamários como surgimento de nódulo e secreção mamilar, podem ocorrer e requerem avaliação apropriada.
- Mamografia e controle do endométrio com USGTV devem ser realizadas em mulheres recebendo terapia com androgênios.
RECOMENDAÇÕES DA SOCIEDADE NORTE-AMERICANA DE MENOPAUSA (NAMS)
- Mulheres com sintomas importantes relacionados a insuficiência androgênica, excluídas outras causas, podem ser candidatas à terapia androgênica, desde que não apresentem contraindicações.
- Recomenda-se que a terapia androgênica seja acompanhada de terapia estrogênica.
- Testes laboratoriais não ajudam no diagnóstico da Síndrome da Insuficiência Androgênica (SIA). Inclusive, várias entidades médicas não reconhecem a SIA como uma síndrome.
- Recomenda-se o uso da terapia androgênica em doses controladas e por período de tempo determinado.
- Recomenda-se individualizar a terapêutica e respeitar as mesmas contraindicações da terapia com estrogênios.
- Recomenda-se o monitoramento dos resultados com base na melhora das queixas do paciente, do bem-estar e no aparecimento de eventos adversos.
- Recomenda-se a avaliação inicial e monitoramento do hemograma, perfil lipídico e do dano e função hepática.
- Não se recomenda o uso de andrógenos em mulheres que possuam fatores de risco pessoais ou familiares associados ao câncer de mama.
CONTRAINDICAÇÕES AO USO DA TERAPIA ANDROGÊNICA
CONTRAINDICAÇÕES RELATIVAS
- Hirsutismo e acne moderada
- Alopecia androgênica
- Hiperlipidemia
- Síndrome metabólica
CONTRAINDICAÇÕES ABSOLUTAS
- Gravidez ou lactação
- Policitemia
- Hiperplasia ou CA endometrial
- CA de mama
- Cardiopatias
- Hepatopatias
- Insuficiência renal
- Acne grave
CONCLUSÃO
- Os sinais e sintomas relacionados ao baixo nível de androgênios podem ser oriundos de várias causas diferentes que devem ser investigadas.
- O uso de medicações como anticoncepcionais, terapias hormonais e corticoides são possíveis causadores da redução dos androgênios nas mulheres.
- A redução da produção de androgênios com o avançar da idade é um processo fisiológico e natural nas mulheres, sendo que algumas irão desenvolver sintomas e outras não.
- O tratamento deve ser individualizado, avaliando principalmente a etiologia e os possíveis riscos e benefícios, tanto das terapias não hormonais, quanto das terapias hormonais.
- Além disso, é fundamental manter uma avaliação clínica e um controle laboratorial recorrente.
- No próximo resumo, discutirei com maiores detalhes os efeitos do excesso de androgênios nas mulheres. Não perca!
REFERÊNCIAS BIBLIOGRÁFICAS
- Fernandes CE, Rennó J Jr., Nahas EAP, Melo NR et al. Síndrome de insuficiência androgênica – Critérios diagnósticos e terapêuticos. Rev Psiq Clin. 2006; 33(3): 152-61.
- Bachmann G, Bancroft J, Braunstein G et al. Female androgen insufficiency: The Princeton consensus statement on definition, classification, and assessment. Fertil Steril. 2002; 77(4): 660-65.
- Lasley BL, Crawford S, McConnell DS. Adrenal androgens and the menopausal transition. Obstet Gynecol Clin North Am. 2011; 38(3): 467-75.
- Couzinet B, Meduri G, Lecce MG, et al. The postmenopausal ovary is not a major androgen-producing gland. J Clin Endocrinol Metab 2001; 86:5060.
- Miller KK, Rosner W, Lee H, et al. Measurement of free testosterone in normal women and women with androgen deficiency: comparison of methods. J Clin Endocrinol Metab 2004; 89:525.
- Davis SR, Davison SL, Donath S et al. Circulating androgen levels and self-reported sexual function in women. JAMA. 2005; 294(1): 91-6.
- Simon J, Braunstein G, Nachtigall L, et al. Testosterone patch increases sexual activity and desire in surgically menopausal women with hypoactive sexual desire disorder. J Clin Endocrinol Metab 2005; 90:5226.
- Davis SR, van der Mooren MJ, van Lunsen RH et al. Efficacy and safety of a testosterone patch for the treatment of hypoactive sexual desire disorder in surgically menopausal women: A randomized, placebo-controlled trial. Menopause. 2006; 13(3): 387-96.
- Miller KK, Biller BM, Beauregard C, et al. Effects of testosterone replacement in androgen-deficient women with hypopituitarism: a randomized, double-blind, placebo-controlled study. J Clin Endocrinol Metab 2006; 91:1683.
- Davis SR, Moreau M, Kroll R, et al. Testosterone for low libido in postmenopausal women not taking estrogen. N Engl J Med 2008; 359:2005.
- The role of testosterone therapy in postmenopausal women: Position statement of The North American Menopause Society. Menopause. 2005; 12(5): 496-511.
- Davis SR, Baber R, Panay N, et al. Global Consensus Position Statement on the Use of Testosterone Therapy for Women. J Clin Endocrinol Metab 2019; 104:4660.
- Shufelt CL, Braunstein GD. Safety of testosterone use in women. Maturitas 2009; 63:63.
- Leder BZ, Leblanc KM, Longcope C, et al. Effects of oral androstenedione administration on serum testosterone and estradiol levels in postmenopausal women. J Clin Endocrinol Metab 2002; 87:5449.
- Elraiyah T, Sonbol MB, Wang Z, et al. Clinical review: The benefits and harms of systemic dehydroepiandrosterone (DHEA) in postmenopausal women with normal adrenal function: a systematic review and meta-analysis. J Clin Endocrinol Metab 2014; 99:3536.
- Elraiyah T, Sonbol MB, Wang Z, et al. Clinical review: The benefits and harms of systemic testosterone therapy in postmenopausal women with normal adrenal function: a systematic review and meta-analysis. J Clin Endocrinol Metab 2014; 99:3543.
- Davis SR, Panjari M, Stanczyk FZ. Clinical review: DHEA replacement for postmenopausal women. J Clin Endocrinol Metab 2011; 96:1642.
- Nijland EA, Weijmar Schultz WC, Nathorst-Boös J, et al. Tibolone and transdermal E2/NETA for the treatment of female sexual dysfunction in naturally menopausal women: results of a randomized active-controlled trial. J Sex Med 2008; 5:646.
- Cayan F, Dilek U, Pata O, Dilek S. Comparison of the effects of hormone therapy regimens, oral and vaginal estradiol, estradiol + drospirenone and tibolone, on sexual function in healthy postmenopausal women. J Sex Med 2008; 5:132.
- Li H, Guo Y, Yang Z, et al. The efficacy and safety of oxandrolone treatment for patients with severe burns: A systematic review and meta-analysis. Burns 2016; 42:717.
- Yeh SS, DeGuzman B, Kramer T, M012 Study Group. Reversal of COPD-associated weight loss using the anabolic agent oxandrolone. Chest 2002; 122:421.
- Jaspers L, Feys F, Bramer WM, et al. Efficacy and Safety of Flibanserin for the Treatment of Hypoactive Sexual Desire Disorder in Women: A Systematic Review and Meta-analysis. JAMA Intern Med 2016; 176:453.
- Koochaki P, Revicki D, Wilson H, et al. Women’s experiences with bremelanotide administered, on demand, for the treatment of hypoactive sexual desire disorder (abstract). J Sex Med 2019; 16:S30.
Com a tagAndrogênios nas mulheres

Ótimo artigo, de fácil leitura e conteúdo completo.